Какой краской покрыта новогодняя игрушка физика
Обновлено: 25.04.2024
Добрый день, дорогие подписчики и гости моего канала.
Сегодня мы с вами поговорим про - амальгаму. Как не странно, мне уже неоднократно присылают вопросы такого плана: "а не опасно ли иметь дома игрушки с амальгамой? Это же ртуть!" Так что я решила ответить на этот вопрос в форме небольшой обзорной статьи.
Сразу поясню - я не химик. Но в силу того, что я занимаюсь елочными игрушками, я много читаю и стараюсь узнавать про технологии, связанные с производством ёлочных игрушек на сколько я могу это делать.
Итак, что есть амальгама?
Амальгамными игрушками называют игрушки, которые имеют серебряное блестящее покрытие. Тут стоит сразу отметить, что слово "амальгама" не совсем корректно, хотя его и используют в качестве обозначения группы игрушек с блестящим серебряным покрытием. Для понимания, когда я обычно пишу "амальгама" относительно советской игрушки - я имею ввиду определение блестящего покрытия на игрушке, а не его состав.
Итак, есть ли в амальгаме ртуть?
Амальгама (лат. amalgama — «сплав») — жидкие или твёрдые сплавы ртути с другими металлами, чаще всего встречаются соединения серебра. Также амальгама может быть раствором ведущих себя аналогично металлам ионных комплексов (например, амальгама аммония).
И да, если смотреть изначально, то амальгама содержит ртуть.
НО в производстве советской ёлочной игрушки ртути нет. Объясню почему.
В советское время использовали два вида блестящего покрытия (то, что мы называем амальгамой): серебряную и алюминиевую. Причем алюминий пришел на смену серебра позже, когда производству требовались дешёвые аналоги.
Различие этих покрытий между собой следующее:
1. Серебряная - это результат реакции серебряного зеркала.
Реакция серебряного зеркала — это реакция восстановления серебра из аммиачного раствора оксида серебра. В водном растворе аммиака оксид серебра растворяется с образованием комплексного соединения — гидроксид диамминсеребра(I) [Ag(NH3)2]OH (информация из Википедии).
Проще говоря: если в колбу налить азотнокислое серебро, добавить аммиачный раствор и глюкозу и подогреть на водяной бане, то металлическая часть осядет на стенки и дно, создавая эффект отражения. Используется в промышленности для производства елочных игрушек, термосов и зеркал. Хранить такой раствор нельзя, потому что он может быть взрывоопасен, так что остатки надо утилизировать.
Ну и собственно ответ на вопрос про содержание в таком покрытии ртути - ее там попросту нет.
Такая амальгама практически всегда внутри игрушки! Отличить ее можно по цвету, размещению внутри игрушки, а так же по характерным окислениям - черные пятна, которые возникают в результате химических реакций серебра (могут возникать от попадания воды, сколов или трещин на стекле игрушек).
Диву дался тут Иван.
«Что, — сказал он, — за шайтан:
Шапок пять найдется свету,
А тепла и дыма нету,
Эко чудо-огонек!
П. П. Ершов. Конек-горбунок
Далеко не все представляют себе, почему часы светятся. Не раз приходилось объяснять — устно и письменно, — что нет, элемент фосфор тут ни при чем. Светом часы обязаны люминофорам — веществам, способным отдавать в виде излучения избыток энергии, которую они получили при возбуждении, или, если хотите, подзарядке, скажем, видимым светом либо ультрафиолетовыми лучами. Довольно часто задают и такой вопрос: не вредно ли это свечение для здоровья? Здесь рассказывается о тех люминофорах, которые наносят на циферблаты и стрелки, о том, из чего их делают и как; коротко сказано и о гигиенической стороне дела.
Впитывающие солнечные лучи
Науке и практикам известно много разных люминофоров. Например, биолюминофоры (возбудитель энергии — биохимическая реакция); электролюминофоры, которые начинают светиться под действием электрического разряда; хемилюминофоры, возбуждаемые химическими реакциями, и многие другие. В часовой промышленности используют только малую часть их, а именно фотолюминофоры и радиолюминофоры.
Если вещество после возбуждения излучает лишь миллиардные доли секунды, то такое свечение называют флюоресценцией (слово происходит от названия плавикового шпата — флюорит; некоторые разновидности его светятся). Когда же вещество испускает лучи минуты, часы, дни, то это явление именуют фосфоресценцией, а светящиеся материалы — фосфорами. Как и название химического элемента, это слово происходит от греческого «фосфорос» — светоносный.
Термин «фосфор» применительно к люминесцирующим веществам появился в середине XVII века — после того, как было обнаружено, что после прокаливания некоторые минералы приобретают способность как бы впитывать солнечные лучи, а потом в темноте их испускать. В 1612 году такими минералами заинтересовался Галилей; он оставил нам одно из первых описаний фосфоресценции, однако причину этого странного явления объяснить не смог.
Прошло еще 250 лет, прежде чем удалось разгадать загадку светящихся камней. В семидесятых годах прошлого столетия английская фирма «Бальмен» начала промышленное изготовление бальменовской светящейся краски. Как и положено, состав ее был секретом фирмы. Однако вскоре он был разгадан французским химиком Вернейлем. Ученый установил, что основа краски — сернистый кальций, а свойство светиться она приобретает благодаря ничтожной примеси солей висмута. Сейчас такие примеси называют активаторами.
Электроны в ловушке
Люминофоры, или кристаллофосфоры, состоят из основы и активатора (например, сернистого кальция и солей висмута, как в бальменовской краске; существует множество других сочетаний). Однако способностью светиться обладает не весь люминофор, а лишь некоторые участки его, так называемые центры свечения, или центры фосфоресценции. Это места, где в кристаллической решетке основы есть нарушения. Вот как они возникают: смесь основы и активатора подвергают термической обработке; тогда строго определенное количество примеси входит в решетку основы и происходит их совместная кристаллизация; там, где это произошло, кристаллическая решетка оказывается нарушенной. Кстати, было обнаружено, что проникновение примеси облегчают легкоплавкие соли — плавни, поэтому при изготовлении люминофора их специально вводят в реакционную массу.
В кристаллофосфоре существуют три энергетические зоны; отличаются они тем, в какой степени их энергетические уровни заполнены электронами; отсюда и название зон: заполненная, или валентная (I), запрещенная (II), незаполненная, или зона проводимости (III). Вероятность попадания электронов идеального кристалла в зону II ничтожно мала, поэтому она и называется запрещенной. Когда же в решетку внедряются специальные примеси — активаторы, то в местах их вхождения в решетку картина изменяется: в зоне II появляются новые уровни — центров свечения (Ц) и ловушек (Л), в которые могут забираться электроны люминофора.
На самом деле, конечно, никаких реальных ловушек тут нет, просто в таком энергетическом состоянии электрон может оставаться довольно долго и после прекращения возбуждения кристалла; природа этого явления до конца еще не ясна. Под действием тепловых колебаний решетки электроны постепенно высвобождаются из ловушек, теряют энергию, и люминофор светится. Было замечено, что длительность послесвечения тем больше, чем ниже расположена ловушка, то есть чем больше энергии требуется для освобождения электрона.
Под действием видимого света или ультрафиолетовых лучей, от соударения с быстро движущимися заряженными частицами (например, альфа- или бета-) электроны люминофора возбуждаются и перемещаются на уровни с более высокой энергией. Возвращаясь затем в исходное состояние, электроны излучают избыток энергии в виде квантов света. Простым глазом мы видим не отдельные вспышки, а сплошной поток света, а вот через лупу можно наблюдать и единичные сцинтилляции, хотя длительность каждой — около 0,00005 секунды.
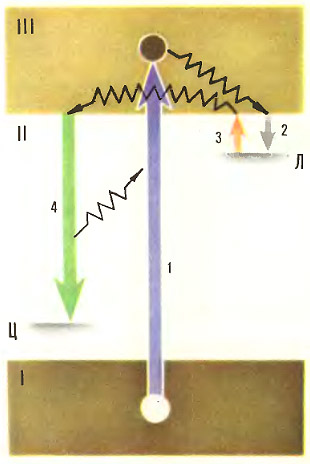
Стрелками обозначены основные переходы, объясняющие послесвечение люминофора:
1 — ионизация люминофора возбуждающим излучением или частицами
2 — захват электрона в ловушку:
3 — высвобождение электрона под действием тепловых колебаний
4 — переход электрона на центр свечения с излучением кванта света
Люминофоры-долгожители
Люминофоры подразделяют на временные и постоянно действующие. Вспомните елочные игрушки, покрытые люминесцентными красками. В состав таких красок входят короткоживущие люминофоры. Лампы выключены. Игрушки светятся ярко. Но через некоторое время их уже не видно. Если опять включить свет и затем выключить, игрушки снова загорятся.
Основу светящихся составов временного действия составляют сернистые соединения цинка, кальция, кадмия, стронция, бария. Их прокаливают с ничтожными количествами солей тяжелых металлов: меди, марганца, висмута. Одни люминофоры светятся голубым светом, другие — красным, третьи — зеленым.
Цвет люминофоров в отраженном дневном свете и цвет их свечения чаще всего не совпадают
Для часов неудобны люминофоры, светящиеся недолго (хотя раньше, а иногда, к сожалению, и сейчас некоторые предприятия такие вещества все-таки используют). Циферблаты должны быть различимы по крайней мере спустя 10—12 часов после освещения. Среди люминофоров временного действия такие составы есть Например, стронций-сульфидный люминофор; он излучает свет около 12 часов без подзарядки. Но у этого вещества есть существенный недостаток: в присутствии влаги происходит гидролиз сульфида стронция и выделяется сероводород — агрессивный газ, разъедающий механизм часов.
В часовом деле все больше применяют люминофоры постоянного действия. К таким долгожителям относятся радиолюминофоры. В их состав, кроме обычных основы и активатора, входит еще и источник энергии — радиоактивное вещество. Люминесцентные смеси такого рода не нуждаются в периодическом освещении: люминофор заставляют работать заряженные частицы, испускаемые радиоактивной добавкой.
К радиоактивным добавкам в часовой промышленности предъявляют строгие требования. Вначале в люминофоры вводили соединения радия-220. Но период его полураспада — 1500 лет. Часы старели, ломались, а циферблат продолжал оставаться источником радиоактивного излучения. В дальнейшем стало ясно, что в люминесцентных составах более приемлемы в качестве источников энергии тритий, прометий-147, углерод-14. Живут они около 10 лет. К тому же эти вещества испускают мягкие бета-лучи, что тоже очень важно.
Чем больше радиоактивного вещества добавляется в фосфоресцирующую массу, тем она ярче светится. Но постоянная бомбардировка заряженными частицами не проходит для самого люминофора бесследно. Если частиц слишком много и они несут слишком большую энергию, центры свечения фосфоров быстро разрушаются. Пустили жильцов в дом, а они его развалили. Поэтому из радиоактивных веществ берут те, что испускают бета-лучи: во-первых, они меньше разрушают люминофор, а, во-вторых, их почти полностью поглощают корпус и стекло часов.
К люминофорам предъявляют жесткие санитарно-гигиенические требования. В свое время была тщательно замерена величина радиоактивного излучения от циферблатов со светомассой постоянного действия, и медики пришли к выводу, что носить часы с такими люминофорами можно, угрозы для здоровья они не представляют. Однако полностью не были решены проблемы производственной вредности: как наносить светящиеся составы, соблюдая при этом правила техники безопасности; куда девать отходы; как хранить большие партии таких часов. Это привело к тому, что в 1958 году в СССР был прекращен выпуск часов с радиоактивной светомассой. Сейчас благодаря усилиям технологов, химиков, медиков и инженеров созданы специальные участки, где готовят и наносят люминофоры; эти участки отвечают всем требованиям техники безопасности.
Люминофор-каприза
Фосфоресцирующая смесь — это бесцветный кристаллический порошок, очень нежный и капризный: разрушение кристаллической решетки или появление посторонних примесей резко уменьшает яркость его свечения. И все-таки некоторой обработке подвергнуть порошок приходится. Хотя бы для того, чтобы приклеить его к циферблату.
Самое лучшее было бы, конечно, заключить кристаллики в прозрачную оболочку и в таком виде прикреплять на часы. Но этот способ возможен не всегда. Значит, нужны связующие: клеи, лаки. С их помощью, кстати, не только удерживают люминофор на циферблате, но и защищают его от воздействия атмосферной влаги, от механических повреждений и даже от ультрафиолетовых лучей, способных разрушить светящееся покрытие.
Наиболее часто в часовой промышленности применяют акриловые, винилитовые и полистирольные лаки; реже используют цапонлак или ацетилцеллюлозный; и особое предпочтение отдают даммаровому паку, он образует прочную прозрачную пленку, непроницаемую для ультрафиолетовых лучей.
Количество связующего, подмешиваемого к люминофору, обычно очень невелико, иначе лак обволакивает кристаллики и сильно уменьшает яркость их свечения. Компоненты осторожно смешивают в стеклянной или фарфоровой посуде, о растирании смеси и речи быть не может. Готовят состав непосредственно перед нанесением. Готовую смесь наносят кистью, пером, стеклянной палочкой, шприцем или с помощью печатной установки.
Сейчас часовая промышленность страны выпускает часы с циферблатами, которые покрыты люминофорами постоянного действия в нескольких вариантах, например «Амфибия» для аквалангистов. (Кроме того по-прежнему делают будильники с циферблатами, на которые нанесена люминесцентная краска, но она плохо выполняет свою роль — через полтора-два часа после подзарядки уже не светится.) В будущем ассортимент часов с люминофорами-долгожителями будет расширяться, производство их увеличится.
Кандидат технических наук Е. Я. Бесидовский,
Научно-исследовательский институт часовой промышленности

Заканчивая наши занятия, научимся еще одной стеклодувной операции — выдуванию шарика (разумеется, это может быть и маленький шарик, размером с горошину, и колба большой емкости). Основные необходимые для этого навыки вы уже приобрели, поэтому сразу примемся за дело.
Как только вы заметите, что «гармошка» вот- вот слипнется, выньте заготовку из пламени и, продолжая ее вращать, немного поддуйте через оттяжку — точно так, как вы это делали, разглаживая шов простого спая. Как только на месте «гармошки» выдуется небольшой шарик (б), внесите его снова в пламя и как следует разогрейте. После этого выньте заготовку и начните не торопясь выдувать шарик (в), нагнетая воздух одними щеками. При этом соблюдайте следующие правила:
1) дуйте не непрерывно, а короткими толчками;
2) оси оттяжек должны в точности совпадать;
3) заготовку надо вращать с такой скоростью, чтобы размягченное стекло не успевало деформироваться под действием собственного веса;
4) руки надо держать все время на одном расстоянии друг от друга; растягивая или сжимая шарик в тот момент, когда вы его выдуваете, ему можно придавать различную форму — удлиненную, как у лимона, или же сплюснутую, как у помидора.
Одного осаживания, как правило, достаточно для того, чтобы выдуть шарик диаметром до 50 миллиметров со стенками нормальной толщины; попрактиковавшись, вы научитесь «на глаз» определять, сколько надо собрать стекла для того, чтобы у шарика определенного диаметра были бы стенки желаемой толщины. Если надо собрать побольше стекла, то операцию осаживания можно повторить. Можно поступить и иначе: после того, как вы разгладили «гармошку» и выдули небольшой шарик, разогрейте соседний участок трубки, соберите на этом месте стекло и выдуйте еще один шарик Затем разогрейте оба шарика одновременно, снова дайте стеклу осесть и на их месте выдуйте один шарик побольше. Повторяя эту операцию несколько раз, можно собрать в одном месте очень много стекла.
Как делать елочные игрушки.
Проще всего выдувать гладкие стеклянные шары (фигурные игрушки, как правило, выдувают в специальных формах). Для этого надо сделать небольшую заготовку, всю ее широкую часть собрать в один небольшой шарик и этот шарик раздуть в большой шар. После того, как известным вам приемом вы отпаяете одну из оттяжек, простейшее елочное украшение готово.
Но стеклодувы, специально занимающиеся выдуванием елочных игрушек, поступают несколько иначе. Сделав заготовку, они отпаивают у нее одну из оттяжек, делают на ее месте круглое дно, потом разогревают всю заготовку, дают немного осесть стеклу, поддувают, прижимая дно каким- либо холодным предметом (можно воспользоваться кафельной плиткой), снова разогревают заготовку и затем выдувают шар. После этого шар серебрят, раскрашивают, оставшуюся оттяжку отрезают и прикрепляют петельку. Игрушка готова.
А вот как можно изготовить стеклянную макушку для елки. Сделайте из трубки диаметром 15—20 миллиметров заготовку длиной 20—25 сантиметров, а затем, отступив от одной из оттяжек сантиметра на два, выдуйте шарик диаметром около 50 миллиметров. Это — нижний шарик макушки. Он будет наряднее, если сделать у него на боках вмятины — «рефлекторы». Для этого разогрейте краем пламени бочок шарика размером с пятак, а когда стекло размягчится, отнимите шарик от пламени и чуть-чуть потяните через оттяжку воздух в себя, одновременно вдавив стекло острым концом напильника (г).
Рядом с этим шариком выдуйте еще один (д). Этот шарик внесите на одну-две секунды в пламя, чуточку потяните — и стенки шарика превратятся в ребристые бока цилиндрической «коробочки». Рядом с этой «коробочкой» выдуйте еще один шарик (е), точно так же разогрейте его и растяните, как и предыдущий, только немного сильнее, причем чуточку перекрутив винтом. Вторая «коробочка» получится длиннее, а ее ребра будут спиральными. Теперь разогрейте оставшийся участок заготовки (ж) и оттяните «шпиль». Чтобы он не был очень узким, оттягивая его, одновременно поддувайте — так, чтобы стенки оттяжки не опадали. Осталось отпаять нижнюю оттяжку (э), сделать на ее месте круглое дно, продуть его, оплавить края отверстия, а затем отпаять верхнюю оттяжку.
Макушка готова — ее осталось только посеребрить и раскрасить.
Как посеребрить и раскрасить елочную игрушку.
Для того чтобы посеребрить елочную игрушку, нужно приготовить два раствора.
Нитрата серебра . 1,6 г Воды 200 мл
Сегнетовой соли . 1,2 г Воды 200 мл
Внутренняя поверхность игрушки должна быть идеально чистой. Если вы хотите заново посеребрить старую игрушку, то ее надо промыть концентрированной азотной кислотой, затем щелочью и, наконец, сполоснуть дистиллированной водой.
Перед употреблением растворы смешивают поровну и наливают полученную смесь в игрушку, заполняя ее примерно на 1/4 объема. Игрушку сильно встряхивают и нагревают в кастрюле с кипящей водой. Через 10—15 секунд внутренняя поверхность покрывается тонким слоем серебра.
Несколько сложнее серебрить игрушки с очень узким горлом, например шарики. Для этого при выдувании шарика у него оставляют оттяжку. Шарик на секунду погружают в кастрюлю с кипящей водой, а потом быстро опускают кончик оттяжки в смесь для серебрения. Через несколько секунд шарик остынет, и под действием вакуума в него втянется немного раствора. Закончив серебрение, шарик переворачивают оттяжкой вниз и снова нагревают (например, коптящим пламенем горелки). Воздух расширится и выдавит из шарика остатки раствора.
Раскрашивают елочные игрушки нитролаком, разбавляя его ацетоном и добавляя анилиновые красители, растворимые в органических веществах. Примерный состав краски таков:
Петельки для подвешивания игрушек на елку делают обычно из стальной проволоки; вы можете заменить их просунутой внутрь шарика спичкой, к середине которой привязана ниточка.

Далеко не все представляют себе, почему игрушки светятся. Фосфор тут ни при чём. Светом игрушки обязаны люминофорам — веществам, способным отдавать в виде излучения избыток энергии, которую они получили при подзарядке видимым светом либо ультрафиолетовыми лучами.
Науке известно много разных люминофоров . Например, биолюминофоры (возбудитель энергии — биохимическая реакция); электролюминофоры , которые начинают светиться под действием электрического разряда; хемилюминофоры , возбуждаемые химическими реакциями, а ещё фотолюминофоры , радиолюминофоры и многие другие.
Если вещество после возбуждения излучает лишь миллиардные доли секунды, то такое свечение называют флюоресценцией (слово происходит от названия плавикового шпата — флюорит ; некоторые разновидности его светятся). Когда же вещество испускает лучи минуты, часы, дни, то это явление именуют фосфоресценцией , а светящиеся материалы — фосфорами . Как и название химического элемента, это слово происходит от греческого «фосфорос» — светоносный .
Термин «фосфор» применительно к люминесцирующим веществам появился в середине XVII века — после того, как было обнаружено, что после прокаливания некоторые минералы приобретают способность как бы впитывать солнечные лучи, а потом в темноте их испускать. В 1612 году такими минералами заинтересовался Галилей ; он оставил нам одно из первых описаний фосфоресценции , однако причину этого странного явления объяснить не смог.
В семидесятых годах позапрошлого столетия английская фирма «Бальмен» начала промышленное изготовление бальменовской светящейся краски. Как и положено, состав её был секретом фирмы. Однако вскоре он был разгадан французским химиком Вернейлем . Учёный установил, что основа краски — сернистый кальций , а свойство светиться она приобретает благодаря ничтожной примеси солей висмута . Сейчас такие примеси называют активаторами.

Люминофоры , или кристаллофосфоры , состоят из основы и активатора (например, сернистого кальция и солей висмута, как в бальменовской краске; существует множество других сочетаний). Однако способностью светиться обладает не весь люминофор , а лишь некоторые участки его, так называемые центры свечения , или центры фосфоресценции. Это места, где в кристаллической решётке основы есть нарушения .
Вот как они возникают: смесь основы и активатора подвергают термической обработке; тогда строго определённое количество примеси входит в решётку основы и происходит их совместная кристаллизация; там, где это произошло, кристаллическая решётка оказывается нарушенной.
Кстати, было обнаружено, что проникновение примеси облегчают легкоплавкие соли — плавни, поэтому при изготовлении люминофора их специально вводят в реакционную массу.
В кристаллофосфоре существуют три энергетические зоны; отличаются они тем, в какой степени их энергетические уровни заполнены электронами; отсюда и название зон: заполненная, или валентная (I) , запрещённая (II) , незаполненная, или зона проводимости (III) .
Вероятность попадания электронов идеального кристалла в зону II ничтожно мала, поэтому она и называется запрещённой. Когда же в решётку внедряются специальные примеси — активаторы, то в местах их вхождения в решётку картина изменяется: в зоне II появляются новые уровни — центров свечения ( Ц ) и ловушек ( Л ), в которые могут забираться электроны люминофора .
На самом деле, конечно, никаких реальных ловушек тут нет, просто в таком энергетическом состоянии электрон может оставаться довольно долго и после прекращения возбуждения кристалла.
Под действием тепловых колебаний решётки электроны постепенно высвобождаются из ловушек, теряют энергию, и люминофор светится.
Было замечено, что длительность послесвечения тем больше, чем ниже расположена ловушка, то есть чем больше энергии требуется для освобождения электрона.
Под действием видимого света или ультрафиолетовых лучей, от соударения с быстро движущимися заряженными частицами (например, альфа- или бета-) электроны люминофора возбуждаются и перемещаются на уровни с более высокой энергией. Возвращаясь затем в исходное состояние, электроны излучают избыток энергии в виде квантов света. Простым глазом мы видим не отдельные вспышки, а сплошной поток света, а вот через лупу можно наблюдать и единичные сцинтилляции, хотя длительность каждой — около 0,00005 секунды .
Вспомните советские ёлочные игрушки , покрытые люминесцентными красками . В состав таких красок входили короткоживущие люминофоры . Лампы выключены. Игрушки светятся ярко. Но через некоторое время их уже не видно. Если опять включить свет и затем выключить, игрушки снова загорятся.
Основу светящихся составов временного действия составляют сернистые соединения цинка, кальция, кадмия, стронция, бария. Их прокаливают с ничтожными количествами солей тяжёлых металлов: меди, марганца, висмута. Одни люминофоры светятся голубым светом, другие — красным, третьи — зелёным.
В советское время использовали люминофоры в производстве часов. Их добавляли, чтобы светились стрелки, циферблат часов. Но использование короткоживущих люминофоров было неудобно (циферблаты должны быть различимы по крайней мере спустя 10-12 часов после освещения), поэтому использовали чаще люминофоры постоянного действия . Хотя, надо заметить, что среди люминофоров временного действия встречаются "долгожители", например, стронций-сульфидный люминофор ; он излучает свет около 12 часов без подзарядки. Но у этого вещества есть существенный недостаток: в присутствии влаги происходит гидролиз сульфида стронция и выделяется сероводород — агрессивный газ, разъедающий механизм часов. Поэтому-то в часовом деле тогда стали применять люминофоры постоянного действия . К таким веществам относятся радиолюминофоры . В их состав, кроме обычных основы и активатора, входит ещё и источник энергии — радиоактивное вещество . Люминесцентные смеси такого рода не нуждались в периодическом освещении: люминофор заставляют работать заряженные частицы, испускаемые радиоактивной добавкой. Естественно, к радиоактивным добавкам в часовой промышленности предъявлялись строгие требования. Вначале в люминофоры вводили соединения радия-220. Но период его полураспада — 1500 лет. Часы старели, ломались, а циферблат продолжал оставаться источником радиоактивного излучения. В дальнейшем стало ясно, что в люминесцентных составах более приемлемы в качестве источников энергии тритий, прометий-147, углерод-14. Живут они около 10 лет. К тому же эти вещества испускают мягкие бета-лучи, что тоже очень важно. Чем больше радиоактивного вещества добавляется в фосфоресцирующую массу, тем она ярче светится. Но постоянная бомбардировка заряженными частицами не проходит для самого люминофора бесследно. Если частиц слишком много и они несут слишком большую энергию, центры свечения фосфоров быстро разрушаются. Пустили жильцов в дом, а они его развалили. Поэтому из радиоактивных веществ брали те, что испускают бета-лучи : во-первых, они меньше разрушали люминофор , а, во-вторых, их почти полностью поглощал корпус и стекло часов.
В своё время была тщательно замерена величина радиоактивного излучения от циферблатов со светомассой постоянного действия , и медики пришли к выводу, что носить часы с такими люминофорами можно, угрозы для здоровья они не представляют.
Однако полностью не были решены проблемы производственной вредности: как наносить светящиеся составы, соблюдая при этом правила техники безопасности; куда девать отходы; как хранить большие партии таких часов. Это привело к тому, что в 1958 году в СССР был прекращен выпуск часов с радиоактивной светомассой .
Современным светящимся ёлочным игрушкам пожары не страшны, ведь эффект послесвечения в том и состоит, что для его поддержания не требуется никаких дополнительных источников света.
Ёлочная игрушка, покрытая светящимся порошком (например, ТАТ33 ), накапливает свет от любого его источника (дневной свет, лампы накаливания и др.) и возвращает эту накопленную энергию, как только внешний источник прекращает свое действие.
Другими словами, как только в комнате выключается свет, игрушки на новогодней ёлке начинают светиться сами по себе. И вам не нужно пользоваться электроприборами для получения этого эффекта – всё работает без дополнительных источников.
Люминофор ТАТ 33 заряжается от любого источника света - солнце, ультрафиолет, обычная лампочка, дневное освещение, фонарик и т.д. и затем светится автономно в темноте (ультрафиолетовая лампа НЕ требуется , свечение полностью автономное).

Технология окраски елочных украшений
В прежнее время стеклянные елочные украшения (шары, верхушки, грибки и различные формовые изделия) чаще всего серебрили и лишь изредка раскрашивали или окрашивали целиком прозрачными лаками.
Около двух лет назад получил широкое распространение новый вид елочных шаров, окрашенных в кроющие (непрозрачные) краски, с изображением на их фоне различных рисунков или узоров.
Эта статья имеет целью передать опыт, накопленный фабрикой игрушки Баумановского промтреста (Москва) по художественной разрисовке и окраске стеклянных елочных украшений.
Для раскраски серебряных елочных украшений обычно употребляется цветной лак цапон (красный, желтый, зеленый). Однако цветной цапон не дает красивых оттенков, поэтому лучше приготовлять цветные лаки самим, используя для этого прозрачный бесцветный лак цапон и какой-нибудь краситель.
Для окраски лака наилучшим красителем является родамин. Для того чтобы приготовить 6 кг красного лака, надо взять 4 кг раствора анил-ацетата или ацетона, всыпать в него не более 50 г родамина, дать ему раствориться, затем прибавить 2 кг цапона и хорошенько размешать.
Желтый лак приготовляется таким же образом, только в качестве красителя применяется желтый анилин. Желтый анилин имеет одну особенность, которую необходимо учесть при приготовлении лака. Он не растворяется и оседает на дно посуды, в которой приготовляется лак. В эту посуду можно в течение долгого времени подливать растворитель и лак цапон, и осадок будет окрашивать их в желтый цвет. При этом не нужно подсыпать желтого анилина, так как излишек его приведет к потере блеска.
Путем смешения желтого и красного лаков можно получить целую гамму оттенков – от золотого до пунцового.
Для зеленого лака в качестве красителя лучше всего брать зеленый родамин; его можно легко заменить зеленым спиртовым лаком или жидкими анилиновыми красками, но при этом следует больше добавлять цапона.
Можно таким же образом приготовить синий и фиолетовый лаки, но они мало пригодны для елочных украшений, потому что слишком темны и не выделяются на елке.
Несколько сложнее обстоит дело с раскраской формовых стеклянных посеребренных изделий, которые не целиком окунаются в цветной лак, а подвергаются лишь частичной раскраске.
Многие руководители цехов художественной раскраски не придают особого значения тому, какие именно части того или иного изделия лучше раскрашивать, и брызгают лаком куда попало. От такой небрежности игрушка проигрывает.
Лучше всего раскрашивать вогнутые части формового изделия (впадины). Положенный туда лак красиво отражается на всех выпуклостях, и игрушка загорается множеством разноцветных точек (для раскраски хорошо использовать два-три цвета). Эффектны серебряные изделия, опрысканные цветными лаками.
Кроющими красками, главным образом, окрашивают шары и лишь изредка формовые изделия.
Для окраски елочных украшений употребляются обычно нитролаки различных марок. Они различно воспринимают влажность воздуха и температуру, при которой производится окраска.
В помещении, где производится окраска, должен быть сухой теплый воздух. В противном случае краска делается матовой и легко сходит. Впрочем, с некоторыми марками нитролаков это происходит и при сухой теплой температуре. В таких случаях необходимо укрепить нитролак, добавив небольшое количество цапона.
Многие фабрики употребляют для окраски шаров окись цинка, разведенную на цапоне и окрашенную небольшим количеством нитролака или жидким анилином. Такая краска дает очень красивые матовые тона.
За неимением нитролака и окиси цинка можно окрашивать шары бесцветным цапоном, разбавленным растворителем до нужной консистенции, с добавлением в качестве красителя тертой масляной краски. Эта краска дает красивый матовый цвет и держится нисколько не хуже нитролака. Кроме того, она дешевле.
После окраски шары поступают в цех художественной разрисовки. Существует мнение, что для того, чтобы выпускать шары со сложными рисунками, необходимо приглашать квалифицированных художников.
Это неверно. На наш
Читайте также:

