При изготовлении зеркал и елочных игрушек серебрение используется
Обновлено: 18.05.2024
М 98227 СССР АНИЕ ТОРС СЕИДЕТЕЛЬСТ А, К, Дорохов, 3, А. Мицкевич, О, А. Бри СПОСОБ СЕРЕБРЕНИЯ С, И. Алие КЛА Министерство легко января 1953 г. за2931/447691 промышленности СССР явлен ликовано в Бюллетене изобретений6 за 1954 г. Предметом изобретения является способ серебрения стекла путем восстановления на его поверхности металлического слоя серебра из аммиачно-комплексных соединений его.Известные аналогичные способы не дают возможности достаточно полно использовать серебро, заключающееся в серебрильном растворе, и значительные количества серебра остаются в отходах серебрения. Обычно выход зеркального серебра при кюветном способе серебрения составляет 10 - 15%, а при серебрении методом налива - 30 - 50%.Предлагаемый способ позволяет увеличить выход зеркального серебра до 50 - 70% при кюветном методе серебрения и до 88 - 95% при серебрении стекла методом налива; одновременно с этим увеличивается толщина слоя серебра, что повышает качество зеркала.Особенность предлагаемого способа заключается в том, что в качестве катализатора в серебрильный раствор вводят 5%-ный спиртовой раствор иода в количестве 0,048 в ,084 лг на 1 л серебрильного раствора.При производстве елочных игрушек и термосных колб для сереореБ РЕТЕ Н Игг ния стекла применяется серебрильый раствор следующего состава:Азотнокислоесеребро . . . 2 г/лЕдкий натр 2 г/л25%-ный водный раствораммиака 7,5 - 1 О гял/л5%-ный спиртовой растворнида 0,048 сял/лПри производстве зеркал примечяются серебрильные растворы следующих составов;а) при трехкратном наливеАзотгокислоесеребро 3,5 г/лЕдкий натр . 3,5 г/л25%-ный водный растиоаммиака 15 - 17 лгл/л5%-ный спиртовый рас вориода 0,048 - 0,084 гил,лб) при двукратном наливеАзотнокислоесеребро . . . 4 г/лЕдкий натр , . 4 г/л25%-ныи водный раствораммиака ., 15 - 20 игл/л5%-ный спиртовый раствориода 0,048 - 0,084 гил lлВосстановителем во всех случаях является 10%нный раствор сахара- рафинада, инвертирсзанный серной кислотой.При серебрении елочных игрушек и термосных колб на одну часть восстановителя берут 150 частей серебЖо 98227 Предмет изооретения Отв, редактор И. В. Макаров Л 134052 от 30/Х 11 1955 г. Стандартгиз. 0,125 п л. Тираж 400. Ц.ена 25 коп. Тип, Московский печатник. Москва, Лялин пер., 6. Зак. 3957 рильного раствора, а при свребрении зеркал восстановитель и серебрильный раствор смешивают в соотношении 1: 100.Необходимое количество азотно- кислого серебра растворяют в небольшом количестве дистиллированной воды и добавляют указанное в рецепте количество 25%-ного водного раствора аммиака, в который предварительно вводят необходимое количество 5%-ного спиртового раствора иода,Растворяют требуемое количество едкого патра в дистиллированной воле и по каплям добавляют в аммиачный раствор азотнокислого серебра,После тщательного перемещения доводят серебрильный раствор до заданного объема.Правильно приготовленный раствор имеет молочноматовый цвет и опалесцирует.Заготовки стекол перед серебрением протирают смесью венской извести и аммиака, промывают ппоточной и затем дистиллированной водой. Ооезжиренные заготовки стекла обрабатывают с помощью губки 0,05%-ным раствором двух- хлористого олова и промывают дистиллированнотл водой.Затем поверхность стекол заливают смесью восстановителя и серебрильного раствора, которую выдеркивает на поверхности стекла 8 - 10 минут.Остатки серебрильной жидкости удаляют с помощью мягкого фетра с поверхности стекла и последнюю тщательно промывают дистиллированной водой. Таким же образом производится иследующий налив.Температуру растворов, выдерживают в пределах 25 - 30.Полученную серебряную пленкусушат в сушильном шкафу при температуре 100 - 150.Серебреиие елочных игрушек производят следующим образом. Поверхность изделий перед серебрением промывают 0,002%-ным раствором двуххлористого олова, затемотмеренное количество обеих составных частей серебрильного раствора смешивают в отдельном сосуде и сразу же полученной смесьюзаливают игрушки.После заливки серебрильпым раствором игрушки взбалтывают в сосуде с горячей водой при температуре около 35 - 40,Полное восстановление серебрапроисходит через 2 - 3 минуты,1, Способ серебреиия стекла путем восстановления на его поверхно. сти металлического слоя серсора из аммиачно-комплексных соединений серебра, отличающийся тем, что, с целью лучшего использования азотнокислого серебра и увеличения толщины отложенной пленки, в качестве катализатора в серебрильный раствор вводят спиртовой раствор иода.2. Прием выполнения спосооа по и. 1, отличающийся тем, что на один литр серебрильного раствора вводят 0,048 - 0,084 лг 5%-ного спиртового раствора иода,
Заявка
Алиев М. И, Бриллиант О. А, Дорохов А. К, Мицкевич З. А
МПК / Метки
Код ссылки
Устройство для получения ионного раствора серебра

Номер патента: 1556679
. калия берут в количестве 30 кг/л. После заполнения сосуда 7 подачу электролита прекращают, перекрывают шланг 5 зажимом 6. Электроды 8 и 9 подключают к генератору 10 стабильного тока, а его подключают в сеть. Предварительно по известным зависимостям рассчитывают время работы, необходимое для получения раствора заданной концентрации, с учетом скорости подачи электролита.В данном случае для концентрации ионного раствора серебра 40 мг/л и объема 1,5 л рассчитанное время работы устройства составляет 50 мин, а скорость подачи электролита 30 мл/мин. Зажимом 6 возобновляют подачу электролита, скорость подачи которого контролируют по расходомеру 12.,Электролит перемещается под давлением из катодного пространства через каналы насадки 11 в.
Устройство для приготовления растворов серебра

Номер патента: 1454467
. бо" лее быстрому проникновению ионов серебра вовнутрь микробных клеток, поскольку при вибрациях повышается проницаемость клеточной оболочки бактерий.От высокочастотных вибраций рабочих элементов 4 температура липосом в полости корпуса 1 повышается. При повышении температуры липосомо выше оптимальной, например 45-48 С, от датчика 12, который расположен в выходном патрубке 3, в блок 11 управления поступает электрический сигнал, от чего включается электродвигатель 10, При вращении электродвигателя 10 через зубчатую передачу 9 приводится но вращение винт 8, от чего торцовые крышки корпуса 1, прикрепленные к салазкам 7, удаляются друг от друга и корпус растягивается, При растягивании корпуса 1 увеличивается расстояние Н (фиг.1) между рабочими.
Устройство для получения ионного раствора серебра

Номер патента: 1637810
. Ц ние производит баритов устрой корпус 1, в верх лены изолирова ряные электрод Применение см стого проницаем локна), имеющ смачивания и у гревателя, обес го вление с ко ентратов, 2 обогащается ионами серебра и выходи него,Таким образом нагреватель 7 обеспечивает постоянную циркуляцию воды через устройство, а большие поверхности пористых проницаемых серебряных электродов 4, с небольшим гидравлическим сопротивлением, д смачиваемых горячей проточной водой 1, обеспечивают интенсивное приготовление серебряной воды и ее концентратов.В верхней части цилиндрического корпуса устройства установлены изолированные пористые проницаемые серебряныевам электроды, ниже которых находится электрический нагреватель. Корпус установлен вертикально в.
Раствор для обработки стекла

Номер патента: 131473
. и изготовлении за р й адгезиониой спо т изобретени Пр я обработки сте а основе примен ем, что он содер гокислого олова одящсе весь объ я сго адгезиоиноивещества, о т л ий кислоты от 32,5 ВОДЫ - ОСтаЛЬНОЕ 1 ШСНИ ащсгосерно анной 0 лглг. кла, с целью повь ния оловосодерж жит 100 о раствора 2,5 г, дистиллиров ем раствора до 5 Раствор д способности, и ч ающийся т до 37,5 л.г, сер количество, доИзвестные растворы для обработки стекла и 1кал оловосодержащим веществом обладают малособностью.Описываемый раствор устраняет этот недостаток. Сущность изобретения заключается в том, что предлагаемый раствор содержит: 10 о раствора серной кислоты от 32,5 до 37,5 тгл, сернокислого олова 2,5 г, дистиллированной воды - остальное количество, доводящее.
Состав мембраны ионоселективного электрода для определения активности ионов серебра в цианидных растворах

Номер патента: 966579
. этом не меняется и оста.ется равным 5,25 10г-ион/л Ад,При концентрации тетрадецилфосфония ме рнее 0,25% электрод не работает. Поэтому занижний предел ионоактивного вещества принята концентрация тетрадецилфосфония 0,25;это соответствует следующему количественно.му соотношению компонентов в мембране,35вес,%: ионный ассоциат 0,25; дибутилфталат69,82; поливинилхлорид 29,93.Мембрана с концентрацией ионоактивноговещества 2,46% более длительное времяудерживает первоначальные характеристикиэлектрода, а также значения потенциаловболее стабильны, чем у электродов с меньшими концентрациями ионоактивного вещества в мембране, Мембрана с концентрациейионоактивного вещества до 11,16%(это соответствует следующему количественному соотношению.

1.Приготовление концентратов растворов серебрения
Приготовление концентрата компонентов серебрильного раствора удобно тем, что можно приготовить любое количество готового рабочего раствора, хоть 100 или даже 50 мл.
Учитывая то, что для серебрения (елочных игрушек) в испытанном мной растворе на 2 части серебрильного раствора добавляется 1 часть раствора-восстановителя, то приготовив даже 50 мл серебрильного раствора, мы имеем общий заливаемый (в игрушку) объем 75 мл. Часто этого вполне достаточно.
Приготовление концентрата серебрильного раствора:
Главный принцип приготовления концентратов состоит в том, что ингредиенты входящие в рецептуру растворяются в 100 мл дистиллированной воды.
Пример:
Возьмем классический рецепт серебрильного раствора.
Серебрильный раствор.
1.
1.
Нитрат серебра 7,2 г/л (дефицит)
2.
Гидроокись натрия (натриевая щелочь) – 4 г/л ( я использовал калиевую щелочь- КОН- её- 6,4 г нужно)
3.
Аммиак – 16 мл/л ( это 25-ти%-й) если 10-ти%-й (из хоз. Магазина)-значит в 2,5 раза больше- 40 мл
Восстановитель:
1.
1.
Формалин (37%) – 1 мл/л
2.
Глюкоза – 5 г/л (куплена в аптеке, продается в сухом виде для каких-то мед. анализов свободно, нужно только найти аптеку где её продают)
Для взвешивания использовал электронные весы с ценой деления 1 г. Можно, но неудобно и грубо. Все сухие вещества взвешивались будучи положены на листок бумаги ( не забудьте учесть вес листка как тары!)
Лучше использовать охотничьи (пороховые) весы. У них цена деления 0,01 г. (продаются в соответствующих охот. Магазинах)
Приготовление:
В чистую, тщательно промытую дистиллированной водой СТЕКЛЯННУЮ или ПОЛИЭТИЛЕНОВУЮ емкость (хорошо использовать емкости для анализов) темного (а вто таких для анализов не бывает, ну ничего) цвета вливается 100 мл дистиллированной воды. Затем в эту воду добавляется отмерянное по рецепту количество нитрата серебра – 7,2 гр., перемешивается. Емкость подписывается «Серебро». Если вы готовите больше концентрата, например, 500 мл, то нитрата серебра добавляется соответственно – 5х7,2=36 гр. Этот концентра следует хранить в темном, прохладном месте. (холодильник)
После того как раствор отстоится, следует обратить внимание, есть ли на дне емкости какие либо взвешенные частицы. Если эти частицы выглядят как белые хлопья – это означает, что использовалась недостаточно чистая вода, в которой присутствовали соли. Они вступили в реакцию с нитратом серебра и образовали хлористое серебро. Если таких белых хлопьев немного ( на дне не более 2 мм осадка), то концентрат достаточно профильтровать через фильтровальную бумагу. При этом раствор будет качественным и на процесс металлизации не повлияет. Если же белых хлопьев больше, то раствор желательно заменить.
Если в концентрате присутствует много пыли, песчинки и другие механические включения, то раствор так же следует профильтровать.
Иногда при приготовлении концентрата через некоторое время раствор приобретает черную окраску. Это означает, что во время приготовления в раствор случайно были внесены посторонние химические ингредиенты. В основном это глюкоза или двухлористое олово, которые восстанавливают серебро до металлического. Такой темный раствор следует заменить. Если же на дне образовался небольшой черный осадок, состоящий из черных включений, то, скорее всего, во время приготовления в концентрат попала гидроокись натрия. Такой раствор так же можно профильтровать и использовать. Если концентрат нитрата серебра на некоторое время оставить на солнце, то раствор потемнеет. Такой раствор использовать нельзя.
Так как нитрат серебра является самым дорогостоящим ингредиентом и испортить концентрат можно не только во время приготовления, но и во время использования, то мы рекомендуем приготавливать не

Так как нитрат серебра является самым дорогостоящим ингредиентом и испортить концентрат можно не только во время приготовления, но и во время использования, то мы рекомендуем приготавливать не более 500 мл концентрата нитрата серебра.
Далее таким же способом приготавливается второй раствор в емкости с надписью «Щелочь». Для этого в 100 мл воды растворяется 4 г гидроокиси натрия (калия). Он идет в сухом виде в виде чешуек. В 500 мл соответственно 4х5=20 г.
В третей емкости с надписью «Аммиак» в 100 мл воды добавляется 40 мл аммиака (это если 10-ти%-й). На 500 мл соответственно 40х5=200 мл. Здесь следует учитывать, что в результате получается не 500 мл концентрата, а 700 мл. Это учитывается при дальнейшем смешивании рабочего серебрильного раствора. На 100 мл воды- 40 мл аммиака= 140 мл концентрата аммиака (учтите. )
Для получения концентрата восстановителя в 100 мл воды растворяется 5 г глюкозы и добавляется 1 мл формалина. Так как дозировка формалина должна быть очень точной, то для этого используется шприц объемом 2 см куб. (только с пластмассовым штоком). Для 500 мл соответственно глюкозы 5х5=25 г, а формалина 1х5=5 мл. Емкость с концентратом восстановителя подписывается литерой «В1». Вот как раз восстановитель можно приготовить сразу, не делая концентрата: просто добавь воды! Т.е. растворить в 1литре дистиллированной воды 5 г. глюкозы
2. Приготовление рабочих растворов серебрения
Допустим нам нужно приготовить 100 мл рабочего серебрильного раствора. 100 мл рабочего раствора – это 1/10 часть от литра. Поэтому для приготовления рабочих растворов следует вливать 1/10 часть конценрата.
Для этого мы в емкость с литерой «Ср» (серебрильный раствор) наливаем 50 мл дистиллированной воды.
Затем берем концентрат «Серебро» (нитрат серебра) и вливаем 1/10 часть от 100 мл, т.е. 100/10=10 мл концентрата в емкость «Ср».
Затем берем концентрат «М3» (аммиак) и вливаем так же 1/10 часть от 140 мл (концентрат аммиака это 100мл воды и 40 мл аммиака10%) 140/10=14 мл в емкость «Ср». При этом раствор может сначала потемнеть, но затем при перемешивании он должен обесцветиться.
Далее берем емкость «Щелочь» (гидроокись калия) и вливаем 1/10 часть от 100 мл, т.е 10 мл в емкость «М». При этом раствор так же может потемнеть, но при перемешивании должен обесцветиться.
У нас получилось – мы добавили 50 мл воды, затем 10 мл концентрата нитрата серебра, затем 14 мл концентрата аммиака, а затем 10 мл концентрата гидроокиси натрия. Получаем 50+10+14+10=84 мл. Но так как мы рассчитывали концентраты на 100 мл рабочего серебрильного раствора, то в емкость «Ср» следует долить 16 мл дистиллированной воды. (Можно долить и 20 мл, так как 4 мл на процесс металлизации не повлияют). Итак, мы получили 100 мл рабочего серебрильного раствора.

Все работы можно провести на кухне под вытяжкой, хотя она и особо не требуется. Только очень слабый запах аммиака, да и то если близко наклониться. А вот руки защищайте, не потому, что "разъест", просто попавший на кожу и особенно ногти рабочий раствор (смесь Ср и Восстановителя) при попадании солнечного света темнеет ( как фотобумага). И сходит с кожи за 2-3 недели, а с ногтей ещё дольше. Промывка ничем не помогает.

Игорь, какой вы молодец! Так все подробно рассказали! Даже просто читать было интересно Надеюсь попробовать все же
Глюкоза С6Н12O6 представляет собой наиболее распространенный и наиболее важный моносахарид — гексозу. Она является структурной единицей большинства пищевых ди- и полисахаридов.
Биологическая роль глюкозы
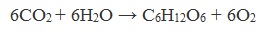
Глюкоза образуется в природе в процессе фотосинтеза, протекающего под действием солнечного света в листьях растений:
Глюкоза – ценное питательное вещество. Она является обязательным компонентом крови и тканей животных и непосредственным источником энергии для клеточных реакций. При окислении ее в тканях освобождается энергия, необходимая для нормальной жизнедеятельности организмов:
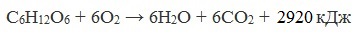
Глюкоза – необходимый компонент обмена углеводов. Она необходима для образования в печени гликогена (запасной углевод человека и животных).
Уровень содержания глюкозы в крови человека постоянен. Во всем объеме крови взрослого человека содержится 5-6 г глюкозы. Такого количества достаточно для покрытия энергетических затрат организма в течение 15 минут его жизнедеятельности.
При снижении ее уровня в крови или высокой концентрации и невозможности использования, как это происходит при сахарном диабете, наступает сонливость, может наступить потеря сознания (гипогликемическая кома).
Строение глюкозы. Изомерия
В молекуле глюкозы присутствуют альдегидная и гидроксильная группы.
Видеоопыт «Распознавание глюкозы с помощью качественных реакций»
Моносахаридам свойственна также иная структура, возникающая в результате внутримолекулярной реакции между карбонильной группой с одним из спиртовых гидроксидов. Такая реакция внутри одной молекулы сопровождается ее циклизацией.

Известно, что наиболее устойчивыми являются 5-ти и 6-ти членные циклы. Поэтому, как правило, происходит взаимодействие карбонильной группы с гидроксилом при 4-м или 5-м углеродном атоме.
В результате взаимодействия карбонильной группы с одной из гидроксильных глюкоза может существовать в двух формах: открытой цепной и циклической.
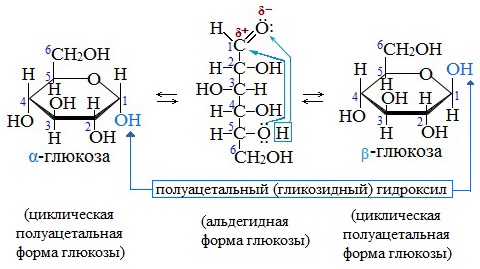
Образование циклической формы глюкозы при взаимодействии альдегидной группы и спиртового гидроксила при С5 приводит к появлению нового гидроксила у С1 называемого полуацетальным (крайний правый). Он отличается от других большей реакционной способностью, а циклическую форму в этом случае называют также полуацетальной.
В кристаллическом состоянии глюкоза находится в циклической форме, а при растворении частично переходит в открытую и устанавливается состояние подвижного равновесия.
Например, в водном растворе глюкозы существуют следующие структуры:
Подвижное равновесие между взаимопревращающимися структурными изомерами (таутомерами) называется таутомерией. Данный случай относится к цикло-цепной таутомерии моносахаридов.
Циклические α- и β-формы глюкозы представляют собой пространственные изомеры, отличающиеся положением полуацетального гидроксила относительно плоскости кольца.
В α-глюкозе этот гидроксил находится в транс-положении к гидроксиметильной группе -СН2ОН, в β-глюкозе – в цис-положении.
С учетом пространственного строения шестичленного цикла
формулы этих изомеров имеют вид:
Видеофильм «Глюкоза и ее изомеры»
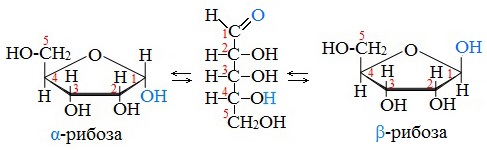
Аналогичные процессы происходят и в растворе рибозы:
В твердом состоянии глюкоза имеет циклическое строение.
Обычная кристаллическая глюкоза – это α-форма. В растворе более устойчива β-форма (при установившемся равновесии на неё приходится более 60% молекул).
Доля альдегидной формы в равновесии незначительна. Это объясняет отсутствие взаимодействия с фуксинсернистой кислотой (качественная реакция альдегидов).
Явление существования веществ в нескольких взаимопревращающихся изомерных формах было названо А. М. Бутлеровым динамической изомерией. Позднее это явление было названо таутомерией.
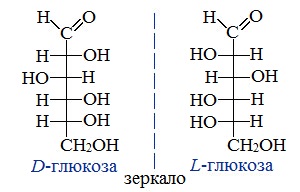
Для глюкозы кроме явления таутомерии характерны структурная изомерия с кетонами (глюкоза и фруктоза – структурные межклассовые изомеры) и оптическая изомерия:
Физические свойства глюкозы
Глюкоза – бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус (лат. «глюкос» – сладкий).
Она содержится в растительных и живых организмах, особенно много ее содержится в виноградном соке (отсюда и название – виноградный сахар), в спелых фруктах и ягодах. Мед в основном состоит из смеси глюкозы с фруктозой.
В крови человека ее содержится примерно 0,1 %
Видеоопыт «Определение глюкозы в виноградном соке»
Получение глюкозы
Основным способом получения моносахаридов, имеющим практическое значения, является гидролиз ди- и полисахароидов.
1. Гидролиз полисахаридов
Глюкозу чаще всего получают гидролизом крахмала (промышленный способ получения):
2. Гидролиз дисахаридов3. Альдольная конденсация формальдегида (реакция А.М. Бутлерова)
Первый синтез углеводов из формальдегида в щелочной среде осуществил А.М. Бутлеров в 1861 году.
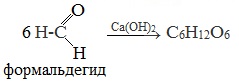
4. Фотосинтез
В природе глюкоза образуется в растениях в результате фотосинтеза:

Применение глюкозы
Глюкоза применяется в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, для приготовления лечебных препаратов, консервирования крови, внутривенного вливания, при самых разнообразных заболеваниях (особенно при истощении организма).
Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.)
Глюкоза находит широкое применение в текстильной промышленности при крашении и печатании рисунков.
Глюкоза применяется в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д.
Она применяется в производстве зеркал и елочных игрушек (серебрение).
В микробиологической промышленности как питательная среда для получения кормовых дрожжей.
Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению.
На практике используется также спиртовое брожение глюкозы, например при производстве пива.
Фруктоза
В отличие от глюкозы она может без участия инсулина проникать из крови в клетки тканей. По этой причине фруктоза рекомендуется в качестве наиболее безопасного источника углеводов для больных диабетом.
Как и глюкоза, она может существовать в линейной и циклических формах. В линейной форме фруктоза представляет собой кетоноспирт с пятью гидроксильными группами.
Строение ее молекулы можно выразить формулой:
Имея гидроксильные группы, фруктоза, как и глюкоза, способна образовывать сахараты и сложные эфиры. Однако вследствие отсутствия альдегидной группы она в меньшей степени подвержена окислению, чем глюкоза. Фруктоза, также как и глюкоза, не подвергается гидролизу.
Фруктоза вступает во все реакции многоатомных спиртов, но, в отличие от глюкозы, не реагирует с аммиачным раствором оксида серебра.
wikiHow работает по принципу вики, а это значит, что многие наши статьи написаны несколькими авторами. При создании этой статьи над ее редактированием и улучшением работали, в том числе анонимно, 14 человек(а).
В наше время зеркала делают, напыляя на стекло алюминий. Но в прежние времена, например в XIX веке, алюминий был недоступен, и зеркала изготовляли, используя серебро. Вы можете сами сделать зеркало при помощи нитрата серебра, который имеется в свободной продаже.

Возьмите 1 грамм нитрата серебра и 1 грамм едкого натра (гидроксида натрия), поместите каждый из них в отдельную емкость и добавьте воду, чтобы они растворились.




Погрузите в раствор объект, который вы хотите посеребрить, или налейте раствор на поднос, на котором лежит этот объект (если он велик, как, например, оконное стекло)


Постепенно раствор окрасится в кремовый цвет, и это будет означать, что стекло покрылось серебром; выньте стеклянный предмет из раствора и сотрите серебрянное покрытие с тех участков, где оно вам не нужно.

Если серебро все же пристало к тем участком поверхности, где вы не хотите его, можете удалить его при помощи соляной кислоты.












Глюкоза – один из самых распространённых углеводов и источников энергии в живых организмах на планете, имеющий формулу C6H12O6.
Глюкоза, формула, молекула, строение, изомерия, вещество:
Глюкоза (виноградный сахар, декстроза или D-глюкоза) – органическое соединение, естественный моносахарид (шестиатомный гидроксиальдегид, гексоза), имеющий формулу C6H12O6.
Глюкоза (от греч. γλυκύς – «сладкий» и суффикса «оза») – один из самых распространённых углеводов и источников энергии в живых организмах на планете.
В быту глюкоза именуется также виноградным сахаром по причине того, что она содержится в винограде и впервые в 1747 году её получил немецкий химик Андреас Маргграф из виноградного сока. Глюкоза также встречается в листьях и других частях растений, соке многих фруктов, овощей и ягод: вишне, черешне, тыкве, малине, сливе, арбузах, яблоках, груше, дыне, персиках, мандаринах, землянике, томатах, капусте, смородине, свекле, финиках, картофеле, крыжовнике, абрикосах, огурцах, клюкве, апельсинах и пр., а также в мёде. Мед в основном состоит из смеси глюкозы с фруктозой. Кроме того, она (глюкоза) содержится во многих бобовых и злаках: пшенице, рисе, овсе, кукурузе, гречке и пр.
Глюкоза – это моносахарид, т.е. простейший углевод, состоящий из одной молекулы или одной структурной единицы.
Она (глюкоза) является структурной единицей большинства пищевых дисахаридов (мальтозы, лактозы и сахарозы) и полисахаридов ( целлюлозы , крахмала, гликогена ). Полисахариды – высокомолекулярные углеводы, полимеры моносахаридов (гликаны). Молекулы полисахаридов представляют собой длинные линейные или разветвлённые цепочки моносахаридных остатков, соединённых гликозидной связью. Олигосахариды – это углеводы , содержащие от 2 до 10 моносахаридных остатков. Дисахариды – углеводы, которые при нагревании с водой в присутствии минеральных кислот или под влиянием ферментов подвергаются гидролизу, расщепляясь на две молекулы моносахаридов.
Химическая формула глюкозы C6H12O6.
Глюкоза принадлежит к классу альдогексоз, то есть является полигидроксиальдегидом.
Глюкоза представляет собой моносахарид, содержащий шесть атомов углерода, одну альдегидную (-CHO) и пять гидроксильных (-OH) групп.
Молекула глюкозы может существовать:
– в виде двух пиранозных циклических форм (α-D-глюкоза и β-D-глюкоза, также именуемые α-D-глюкопираноза и β-D-глюкопираноза), отличающихся пространственным расположением одной гидроксильной группы. Пиранозы – моносахариды, находящиеся в циклической форме и содержащие шестичленное (пирановое) кольцо,
– в виде двух фуранозных циклических форм (α-D-глюкофураноза и β-D-глюкофураноза), отличающихся пространственным расположением одной гидроксильной группы. Фуранозы – моносахариды, находящиеся в циклической форме и содержащие пятичленное (фурановое) кольцо,
– и в виде линейной – открытой цепной (ациклической) форме (D-глюкоза, также именуемая декстроза).
Циклическая форма глюкозы является результатом внутримолекулярной реакции между атомом альдегида C и гидроксильной группой C-5 линейной формы глюкозы (D-глюкозы). ОН-группа при углероде С-5 присоединяется к альдегидной группе с образованием внутримолекулярного полуацеталя. Циклические α- и β-формы глюкозы представляют собой пространственные изомеры, отличающиеся положением полуацетального гидроксила относительно плоскости кольца. В α-D-глюкозе этот гидроксил находится в транс-положении к гидроксиметильной группе –СН2ОН, в β-D-глюкозе – в цис-положении.
В циклической форме глюкоза находится в кристаллическом, твердом состоянии. Обычная кристаллическая глюкоза – это α-форма (α-D-глюкопираноза).
При растворении в воде глюкоза частично переходит в открытую цепную форму, где устанавливается состояние подвижного равновесия между указанными тремя формами. В растворе более устойчива β-форма (β-D-глюкопираноза). Линейная форма глюкозы составляет менее 0,02% молекул глюкозы в водном растворе, остальное приходится – на циклические формы. Равновесная доля α-D-глюкопиранозы при 31 °C составляет 38 %, а более устойчивой β-D-глюкопираноза – 62 %. В растворах α-D-глюкопираноза и β-D-глюкопираноза взаимопревращаются друг в друга через образование открытой цепной формы.
Наряду с наиболее распространённой в природе открытой цепной (ациклической) формой – D-глюкозой существует также её энантиомер L-глюкоза, которая в природе практически не встречается и получается искусственным путем. L-глюкоза не имеет значительного применения.
Строение молекулы глюкозы, структурная формула глюкозы:

Рис. 1. α-D-глюкопираноза

Рис. 2. β-D-глюкопираноза

Рис. 3. D-глюкоза (декстроза)

Рис. 4. D-глюкоза (слева) и L-глюкоза (справа)
Систематическое химическое наименование глюкозы: (2R,3S,4R,5R)-2,3,4,5,6-пентагидроксигексаналь (для ациклической формы – D-глюкозы). Используются также и другие химические названия глюкозы: декстроза (для ациклической формы – D-глюкозы).
По внешнему виду глюкоза представляет собой белое кристаллическое вещество , со сладким вкусом, без запаха. Однако сладость глюкозы вдвое ниже, чем сахарозы.
Глюкоза очень хорошо растворяется в воде. Растворимость в воде составляет 32,3 г на 100 г воды (при 0 °C), 82 г/100 г (при 25 °C), 562 г/100 г (при 90,8 °C). Хорошо растворима также в аммиачном растворе гидроксида меди (реактив Швейцера), серной кислоте, хлориде цинка. Малорастворима в этаноле и метаноле.
Калорийность глюкозы – 388,7 ккал на 100 г сухого вещества.
Биологическая роль глюкозы:
В организме человека и животных глюкоза является основным и наиболее универсальным источником энергии для обеспечения метаболических процессов. Глюкоза является ценным питательным веществом. При окислении глюкозы в тканях человека и животных освобождается энергия, необходимая для нормальной жизнедеятельности организмов.
Глюкоза депонируется у человека и животных в виде гликогена, который хранится преимущественно в клетках печени (гепатоцитах) и скелетных мышцах. В крови человека также содержится порядка 5-6 г глюкозы. Уровень глюкозы в крови человека постоянен. Данного количества глюкозы достаточно для покрытия энергетических затрат организма в течение 15 минут его жизнедеятельности.
У растений глюкоза образуется в результате фотосинтеза и накапливается в виде крахмала и целлюлозы. Последняя представляет собой составную часть оболочки клеток растений , обеспечивая механическую прочность и эластичность растительной ткани.
Физические свойства глюкозы:
| Наименование параметра: | Значение: |
| Цвет | белый, бесцветный |
| Запах | без запаха |
| Вкус | сладкий |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое кристаллическое вещество |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), г/см 3 | 1,562 |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1562 |
| Температура разложения, °C | — |
| Температура плавления α-D-глюкозы, °C | 146 |
| Температура плавления β-D-глюкозы, °C | 148–150 |
| Температура кипения, °C | — |
| Молярная масса глюкозы, г/моль | 180,16 |
Получение и производство глюкозы:
В природе глюкоза образуется в результате реакции фотосинтеза и содержится в различных частях растений: листьях и плодах. У животных глюкоза образуется в результате расщепления гликогена.
Глюкоза образуется в ходе следующих химических реакций:
1. реакции сахарозы с водой (гидролиз сахарозы):
При гидролизе (при нагревании в присутствии ионов водорода ) сахароза расщепляется на составляющие ее моносахариды – глюкозу и фруктозу за счёт разрыва гликозидных связей между ними. Данная реакция является обратной процессу образования сахарозы из моносахаридов.
Аналогичная реакция происходит в кишечнике у живых организмов при попадании в него сахарозы. В кишечнике сахароза под действием ферментов быстро гидролизуется на глюкозу и фруктозу.
2. реакции мальтозы с водой (гидролиз мальтозы):
При гидролизе (при нагревании в присутствии ионов водорода ) мальтоза расщепляется на составляющие ее моносахариды – две молекулы глюкозы за счёт разрыва гликозидных связей между ними. Данная реакция является обратной процессу образования мальтозы из моносахаридов.
Аналогичная реакция происходит в кишечнике у живых организмов при попадании в него мальтозы. В кишечнике сахароза под действием ферментов быстро гидролизуется на две молекулы глюкозы.
3. реакции крахмала с водой (гидролиз крахмала):
Важнейшее свойство крахмала – способность подвергаться гидролизу под действием ферментов или при нагревании с кислотами.
Гидролиз протекает ступенчато. Из крахмала сначала образуется декстрин ((C6H10O5)n), который гидролизуется до мальтозы (C12H22O11). Затем в результате гидролиза мальтозы образуется глюкоза (С6Н12O6).
Аналогичная реакция происходит во рту, желудке и кишечнике у живых организмов при попадании в него крахмала. В желудке и кишечнике крахмал под действием ферментов окончательно гидролизуется на глюкозу.
Данная реакция используется в качестве промышленного способа получения глюкозы.
4. реакции А.М. Бутлерова – альдольной конденсации формальдегида:
Первый синтез углеводов из формальдегида в щелочной среде осуществил А.М. Бутлеров в 1861 году.
Формальдегид под действием гидроксидов щелочноземельных металлов вступает в реакцию самоконденсации, образуя при этом смесь углеводов («формозу»), в т.ч. глюкозу.
5. реакции фотосинтеза:
В природе глюкоза образуется в растениях в результате фотосинтеза из углекислого газа и воды под действием солнечного света в листьях растений. В ходе реакции помимо глюкозы образуется кислород.
6. реакции гидролиза гликогена в кислой среде:
Важнейшее свойство гликогена – способность подвергаться гидролизу в водных растворах кислот.
Химические свойства глюкозы. Химические реакции (уравнения) глюкозы:
Основные химические реакции глюкозы следующие:
1. реакции ферментативного брожения глюкозы:
Важнейшим химическим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента соответственно различают реакции следующих видов:
1.1. реакцию спиртового брожения глюкозы:
В результате данной реакции образуются этиловый спирт (этанол) и углекислый газ .
Реакция происходит под действием дрожжевых грибков.
1.2. реакцию молочнокислого брожения глюкозы:
В результате данной реакции образуется молочная кислота.
Реакция происходит под действием бактерий.
1.3. реакцию маслянокислого брожения глюкозы:
В результате данной реакции образуются масляная кислота, водород и углекислый газ.
Реакция происходит под действием бактерий.
Благодаря брожению получают продукты питания – кефир, сыр, алкоголь.
2. реакция глюкозы с водородом:
Глюкоза вступает в реакцию с водородом в присутствии катализатора (в качестве которого используется никель) при высокой температуре. В результате реакции образуется шестиатомный спирт (сорбит).
3. качественная реакция на глюкозу (реакция глюкозы с гидроксидом меди):
В молекуле глюкозы имеется несколько гидроксильных групп. Для подтверждения их наличия используют реакцию с гидроксидами металлов , например, с гидроксидом меди , имеющим голубой цвет. Для этого к раствору глюкозы добавляют гидроксид меди . В результате образуются глюконовая кислота, оксид меди (I) и вода, а раствор окрашивается из голубого цвета в красный цвет, т.к. оксид меди (I) обладает красным цветом.
4. качественная реакция «серебряного зеркала» – реакция глюкозы с аммиачным раствором оксида серебра (I):
В молекуле глюкозы имеется альдегидная группа. Поэтому она при нагревании с аммиачным раствором оксида серебра окисляется и дает реакцию «серебряного зеркала».
В результате образуются глюконовая кислота и серебро, которое выпадает в осадок. Если реакция проводится в сосуде с чистыми и гладкими стенками, то серебро осаждается на них в виде тонкой плёнки, образуя зеркальную поверхность. При наличии малейших загрязнений серебро выделяется в виде серого рыхлого осадка.
Таким образом, глюкоза обладает восстанавливающими свойствами, т.к. она восстанавливает Ag2O и Cu(OH)2.
5. в организме человека глюкоза подвергается сложным биохимическим превращениям:
В результате сложных биохимических превращений образуется углекислый газ и вода, при это выделяется энергия 2800 кДж на 1 моль глюкозы.
6. глюкоза не вступает в некоторые реакции, характерные для альдегидов, например, в реакцию с гидросульфитом натрия.
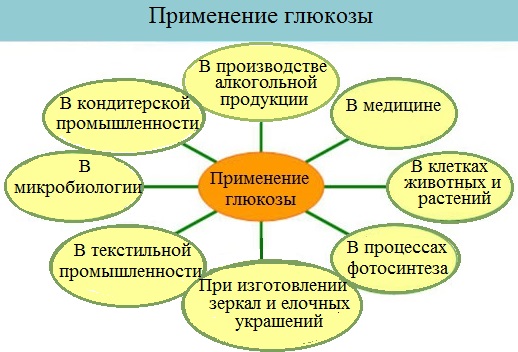
Применение глюкозы:
Глюкоза используется в различных отраслях промышленности и быту:
– в медицине в качестве лечебного средства, для приготовления лечебных препаратов и пр.;
– в пищевой промышленности при выпечке хлеба, а также при производстве сгущённого молока и мороженого, в кондитерском деле при изготовлении мармелада, карамели, пряников и т.д.;
– в сельском хозяйстве в пчеловодстве для подкормки пчёл;
– в текстильной промышленности при крашении и печатании рисунков;
– в химической промышленности в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д.;
– в производстве зеркал и елочных игрушек (серебрение);
– в микробиологической промышленности как питательная среда для получения кормовых дрожжей;
– в приготовлении пищи и кормов для животных используются процессы молочнокислого, спиртового и маслянокислого брожения.
Читайте также:

